2. radostinalassa
3. leonleonovpom2
4. varg1
5. kvg55
6. mt46
7. wonder
8. planinitenabulgaria
9. sparotok
10. hadjito
11. getmans1
12. stela50
13. zaw12929
14. deathmetalverses
2. katan
3. wonder
4. leonleonovpom2
5. mt46
6. bojil
7. vidima
8. dobrota
9. ambroziia
10. donkatoneva
2. vesonai
3. radostinalassa
4. lamb
5. hadjito
6. samvoin
7. manoelia
8. bateico
9. mimogarcia
10. sekirata

Прочетен: 310 Коментари: 0 Гласове:
Последна промяна: 30.08.2021 18:29
24.08.2021 г. / От Итън Хъф /
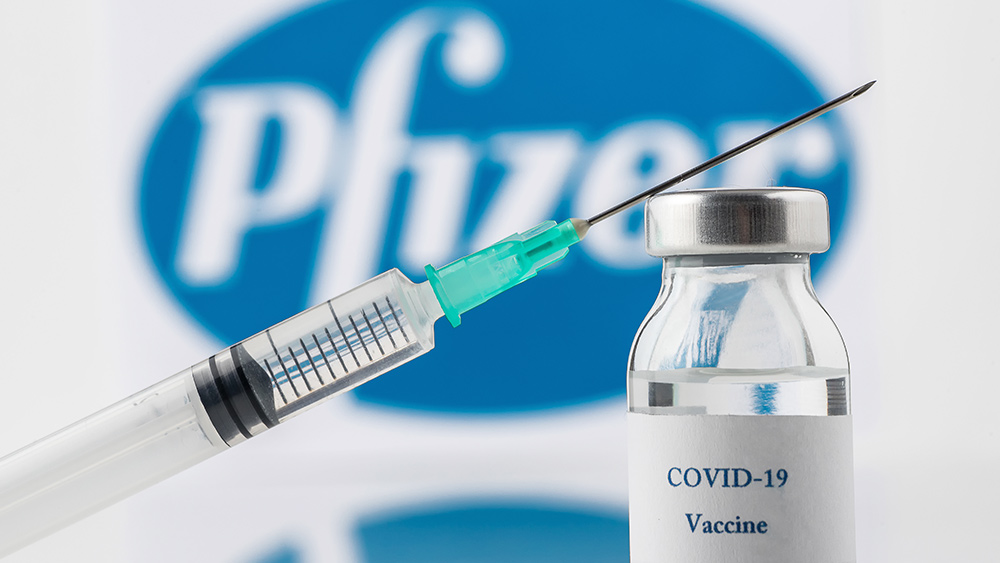
Изглежда има голямо объркване относно това коя „ваксина“ за коронавирус от Ухан (Covid-19) всъщност е „одобрена“ от Американската администрация по храните и лекарствата (FDA) на 23 август 2021 г.
Докато много водещи медии бързо се разнесоха с историята, че на съществуващата инжекция на Pfizer за мРНК за грипа Fauci е дадена официалната зелена светлина от FDA, което улеснява упълномощаването, други казват , че FDA е издала одобрение специално на BioNTech, немски корпорация за ваксини, за инжекция с китайски вирус, която все още не съществува .
BioNTech, както може би си спомняте, си партнира с Pfizer, за да произведе настоящия изстрел от грип на Fauci, който се прилага съгласно разрешение за спешна употреба (EUA). Оказва се обаче, че това технически е различен изстрел от марката „Comirnaty“, посочена в неотдавнашното съобщение за одобрение на FDA.
Тя ще изглежда, като че ли е налице масово съзнание контрол против , които се провеждат в момента, в който обичайните заподозрени са нищожен объркващо, ако не и неверни , разказ, че инжектиране на ток Pfizer е получил "пълно одобрение" от FDA. И така, каква е истинската истина?
Според д -р Робърт Малоун, изобретател на месинджър РНК технологията, официалните документи на FDA не показват , въз основа на неговите собствени показания, че е получено пълно одобрение за инжектирането на Pfizer. Това, казва той, предстои около 2023 г.-не забравяйте да гледате интервюто от няколко части по-долу, за да научите повече:
https://www.brighteon.com/d58fca9d-546b-4069-a1ce-327b6631e320 Tanya Rose @TanyaRo58329998 MEDIA TRICK/CON ABOUT FDA "APPROVAL" @RWMaloneMD "inventor" of mRNA explains @clif_high @JamesMelville @beverleyturner @BernieSpofforth @BreesAnna @JuliaHB1 @louisaclary @GillianMcKeith @SuzanneEvans1 @emmakennytv @thecoastguy @FatEmperor @WendyPuerto @JohnBoweActor #FDAapproved
Tanya Rose @TanyaRo58329998 MEDIA TRICK/CON ABOUT FDA "APPROVAL" @RWMaloneMD "inventor" of mRNA explains @clif_high @JamesMelville @beverleyturner @BernieSpofforth @BreesAnna @JuliaHB1 @louisaclary @GillianMcKeith @SuzanneEvans1 @emmakennytv @thecoastguy @FatEmperor @WendyPuerto @JohnBoweActor #FDAapproved  7:55 PM · Aug 24, 2021
7:55 PM · Aug 24, 2021  JohnnyFantom @JohnnyFantom5 · Aug 24, 2021 Replying to @TanyaRo58329998 @RWMaloneMD and 14 others Anybody able to share the full video please
JohnnyFantom @JohnnyFantom5 · Aug 24, 2021 Replying to @TanyaRo58329998 @RWMaloneMD and 14 others Anybody able to share the full video please  Tanya Rose @TanyaRo58329998 Part 2
Tanya Rose @TanyaRo58329998 Part 2  8:42 PM · Aug 24, 2021 Значи наистина ударите на Pfizer са „одобрени“ или не?
8:42 PM · Aug 24, 2021 Значи наистина ударите на Pfizer са „одобрени“ или не?
В случай, че не сте запознати с д -р Малоун, той наскоро обърна капака на опасностите от прилагането на инжекции с тРНК в разгара на пандемия, опасявайки се, че може да бъде убит, за да представи тази информация в момент, когато правителството и медиите са агресивно натискане на изстрелите като окончателно решение.
Сега д -р Малоун оспорва последното твърдение на правителството и медиите, че изстрелът на Pfizer е напълно одобрен от FDA, когато това може да не е така, въз основа на формулировката на одобрението.
От друга страна, собственото етикетиране на Pfizer предполага, че настоящият му удар, разрешен съгласно EUA, е същият като Comirnaty и че двата са основно взаимозаменяеми.
„Одобрената от FDA COMIRNATY (ваксина срещу COVID-19, мРНК) и разрешената от EU ваксина Pfizer-BioNTech COVID-19 имат една и съща формулировка и могат да се използват взаимозаменяемо за осигуряване на серия от ваксинации срещу COVID-19“, се посочва в документа на Pfizer.
На този етап не е ясно какво точно се случва, но искахме да предоставим на вашето внимание тази противоречива информация. На пръв поглед изглежда, че медицинските фашисти отново се опитват да изтласкат масово масата, за да оправдаят „задължителните“ схеми за ваксинация, предназначени да поробят света под управлението на Голямата фармация.
Публикувано от FDA на 23 август допълнително предполага, че агенцията смята, че Comirnaty и настоящата инжекция Pfizer се прилагат като едно и също и че името се променя само защото лекарството е получило пълно одобрение.
„Ваксината е известна като Pfizer-BioNTech ваксина срещу COVID-19 и сега ще бъде пусната на пазара като Comirnaty (koe-mir"-na-tee), за превенция на болестта COVID-19 при лица на 16 и повече години ”, Казва агенцията, привидно подкрепяйки това, което медиите твърдят за одобрението.
„Ваксината също продължава да бъде достъпна съгласно разрешение за спешна употреба (EUA), включително за лица на възраст от 12 до 15 години и за прилагане на трета доза при някои имунокомпрометирани индивиди.
Тъй като новините се развиват по този въпрос, ние ще ви държим в течение за най -новото в Pandemic.news .
Източниците на тази статия включват:
RumorMillNews.com
Twitter.com
Twitter.com
NaturalNews.com
Pfizer
FDA.gov
PFIZER-BIONTECH COVID-19 VACCINE- bnt162b2 инжекция, окачване
Pfizer Manufacturing Belgium NV
----------
ПАЙЦЕР-БИОНТЕХ ВАКСИНА ЗА COVID-19
ИНСТРУКЦИЯ ЗА ДОСТАВЧИКИТЕ НА ЗДРАВНИТЕ ЗДРАВИ, ПРЕДЛАГАЩИ ВАКСИНА (ДОСТАВЧИКИ НА ВАКЦИНАЦИИТЕ)
АВТОРИЗАЦИЯ ЗА АВАРИЙНО ИЗПОЛЗВАНЕ (EUA) НА ВАКСИНАТА PFIZER-BIONTECH COVID-19 ЗА ПРЕДОТВРАТЯВАНЕ НА КОРОНАВИРУСНА БОЛЕСТ 2019 (COVID-19)
Американската администрация по храните и лекарствата (FDA) издаде разрешение за спешна употреба (EUA), за да разреши спешната употреба на неодобрения продукт, ваксината Pfizer-BioNTech COVID-19, за активна имунизация за предотвратяване на COVID-19 при лица на 12-годишна възраст и по -възрастни и да осигурят трета доза на лица на 12 и повече години, за които е установено, че имат определени видове имунокомпромис.
COMIRNATY (ваксина срещу COVID-19, мРНК) е одобрена от FDA ваксина срещу COVID-19, произведена от Pfizer за BioNTech. Той е одобрен като серия от 2 дози за профилактика на COVID-19 при лица на възраст 16 и повече години и също така е разрешен за спешна употреба при лица от 12 до 15 години и за предоставяне на трета доза на лица на възраст 12 години и по -възрастни, за които е установено, че имат определени видове имунокомпромис.
Одобрената от FDA COMIRNATY (ваксина срещу COVID-19, мРНК) и разрешената от EUA ваксина Pfizer-BioNTech COVID-19 имат една и съща формулировка и могат да се използват взаимозаменяемо за осигуряване на серия от ваксинации срещу COVID-19. 1
РЕЗЮМЕ НА ИНСТРУКЦИИТЕ ЗА ДОСТАВЧИЦИТЕ НА ВАКСИНАЦИЯ COVID-19
Доставчиците на ваксини, включени във федералната програма за ваксиниране срещу COVID-19, трябва да докладват всички грешки при прилагане на ваксината, всички сериозни нежелани събития, случаи на мултисистемния възпалителен синдром (MIS) при възрастни и деца и случаи на COVID-19, които водят до хоспитализация или смърт след прилагане на ваксината Pfizer-BioNTech COVID-19. Вижте „ ЗАДЪЛЖИТЕЛНИ ИЗИСКВАНИЯ ЗА АДМИНИСТРИРАНЕ НА ВАКСИНА PFIZER-BIONTECH ПРОТИВ АВТОРИЗАЦИЯ ЗА АВАРИЙНО ИЗПОЛЗВАНЕ “ за изисквания за докладване.
Ваксината Pfizer-BioNTech COVID-19 е суспензия за интрамускулно инжектиране, прилагана като серия от две дози (по 0,3 ml всяка) с интервал от 3 седмици.
Трета доза от ваксината Pfizer-BioNTech COVID-19 (0,3 ml), приложена най-малко 28 дни след втората доза от тази ваксина, е разрешена за прилагане на лица на възраст най-малко 12 години, които са претърпели трансплантация на твърди органи или диагностицирани със състояния, за които се счита, че имат еквивалентно ниво на имунокомпромис.
Вижте този Информационен бюлетин за инструкции за подготовка и приложение. Този информационен бюлетин може да е актуализиран. За най -новия информационен бюлетин, моля, вижте www.cvdvaccine.com.
За информация относно клиничните изпитвания, които тестват използването на ваксината Pfizer-BioNTech COVID-19 за активна имунизация срещу COVID-19, моля, вижте www.clinicaltrials.gov .
ОПИСАНИЕ НА COVID-19
Коронавирусната болест 2019 (COVID-19) е инфекциозно заболяване, причинено от новия коронавирус, SARS-CoV-2, който се появи в края на 2019 г. Това е предимно респираторно заболяване, което може да засегне други органи. Хората с COVID-19 съобщават за широк спектър от симптоми, вариращи от леки до тежки заболявания. Симптомите могат да се появят 2 до 14 дни след излагане на вируса. Симптомите могат да включват: треска или втрисане; кашлица; задух; умора; мускулни или телесни болки; главоболие; нова загуба на вкус или мирис; възпалено гърло; запушване или хрема; гадене или повръщане; диария.
ДОЗИРОВКА И АДМИНИСТРАЦИЯ
Съхранение и манипулиране
По време на съхранение минимизирайте излагането на стайна светлина и избягвайте излагането на пряка слънчева светлина и ултравиолетова светлина.
Не замразявайте отново размразените флакони.
Замразени флакони преди употреба
Кашоните с многодозови флакони с ваксина Pfizer-BioNTech COVID-19 пристигат в термоконтейнери със сух лед. Веднъж получени, картонените опаковки на флакона веднага се изваждат от термоконтейнера и за предпочитане се съхраняват във фризер с ултра ниска температура между -90єC до -60єC (-130єF до -76єF) до срока на годност, отпечатан върху етикета. Тази информация в листовката замества условията за съхранение, отпечатани върху картонените опаковки на флакона.
Кашоните и флаконите с ваксина Pfizer-BioNTech срещу COVID-19 със срок на годност от август 2021 г. до февруари 2022 г., отпечатани на етикета, могат да останат в употреба в продължение на 3 месеца след отпечатаната дата, стига одобрените условия за съхранение между -90єC до -60єC (- 130єF до -76єF) са поддържани. Актуализираните дати на годност са показани по -долу.
| Отпечатана дата на изтичане | Актуализирана дата на изтичане | |
|---|---|---|
| Август 2021 г. | ➜ | Ноември 2021 г. |
| Септември 2021 г. | ➜ | Декември 2021 г. |
| Октомври 2021 г. | ➜ | Януари 2022 г. |
| Ноември 2021 г. | ➜ | Февруари 2022 г. |
| Декември 2021 г. | ➜ | Март 2022 г. |
| Януари 2022 г. | ➜ | Април 2022 г. |
| Февруари 2022 г. | ➜ | Май 2022 г. |
Ако не се съхраняват между -90єC до -60єC (-130єF до -76єF), флаконите могат да се съхраняват при -25 ° C до -15 ° C (-13 ° F до 5 ° F) за период до 2 седмици. Флаконите трябва да се съхраняват замразени и защитени от светлина до готовност за употреба. Флаконите, съхранявани при -25 ° C до -15 ° C (-13 ° F до 5 ° F) за период до 2 седмици, могат да бъдат върнати еднократно при препоръчаните условия за съхранение от -90єC до -60єC (-130єF до -76єF) . Общото време за съхранение на флаконите при -25 ° C до -15 ° C (-13 ° F до 5 ° F) трябва да бъде проследено и не трябва да надвишава 2 седмици.
Ако фризер със свръхниска температура не е наличен, термичният контейнер, в който пристига ваксината Pfizer-BioNTech COVID-19, може да се използва като временно съхранение, когато се напълва постоянно до върха на контейнера със сух лед. Вижте указанията за повторно заледяване, опаковани в оригиналния термоконтейнер за инструкции относно използването на термоконтейнера за временно съхранение . Термоконтейнерът поддържа температурен диапазон от -90єC до -60єC (-130єF до -76єF). Съхранението на флаконите между -96 ° C до -60 ° C (-141 ° F до -76 ° F) не се счита за екскурзия от препоръчаното условие за съхранение.
Транспортиране на замразени флакони
Ако е необходимо локално преразпределение и пълните картонени опаковки, съдържащи флакони, не могат да се транспортират при -90 ° C до -60 ° C (-130 ° F до -76 ° F), флаконите могат да се транспортират при -25 ° C до -15 ° C ( -13 ° F до 5 ° F). Всички часове, използвани за транспортиране при -25 ° C до -15 ° C (-13 ° F до 5 ° F), се отчитат от 2 -седмичния лимит за съхранение при -25 ° C до -15 ° C (-13 ° F до 5 ° F). Замразените флакони, транспортирани при -25 ° C до -15 ° C (-13 ° F до 5 ° F), могат да бъдат върнати еднократно при препоръчаните условия за съхранение от -90єC до -60єC (-130єF до -76єF).
Размразени флакони преди разреждане
Размразени в хладилник
Размразете и след това съхранявайте неразредените флакони в хладилник [2єC до 8єC (35єF до 46єF)] за период до 1 месец. Картонена кутия с 25 флакона или 195 флакона може да отнеме съответно до 2 или 3 часа, за да се размрази в хладилника, докато по -малък брой флакони ще се размразят за по -малко време.
Размразени при стайна температура
За незабавна употреба размразете неразредените флакони при стайна температура [до 25єC (77єF)] за 30 минути. Размразените флакони могат да се използват при стайна светлина. Флаконите трябва да достигнат стайна температура преди разреждане.
Неразредените флакони могат да се съхраняват при стайна температура за не повече от 2 часа.
Транспортиране на размразени флакони
Наличните данни поддържат транспортиране на един или повече размразени флакони при 2 ° C до 8 ° C (35 ° F до 46 ° F) за до 12 часа.
Флакони след разреждане
- След разреждане, съхранявайте флаконите между 2 ° C и 25 ° C (35 ° F до 77 ° F) и използвайте в рамките на 6 часа от момента на разреждане.
- По време на съхранение минимизирайте излагането на стайна светлина и избягвайте излагането на пряка слънчева светлина и ултравиолетова светлина.
- Всички ваксини, останали във флакони, трябва да се изхвърлят след 6 часа.
- Не замразявайте отново.
Дозиране и график
Ваксината Pfizer-BioNTech COVID-19 се прилага интрамускулно като серия от две дози (по 0,3 ml всяка) с интервал от 3 седмици.
Одобрената от FDA COMIRNATY (ваксина срещу COVID-19, мРНК) и разрешената от EUA ваксина Pfizer-BioNTech COVID-19 имат една и съща формулировка и могат да се използват взаимозаменяемо за осигуряване на серия от ваксинации срещу COVID-19. 2
Няма налични данни за взаимозаменяемостта на ваксината Pfizer-BioNTech срещу COVID-19 или COMIRNATY (ваксина срещу COVID-19, мРНК) с други ваксини срещу COVID-19 за завършване на поредицата от ваксинации.
Трета доза от ваксината Pfizer-BioNTech COVID-19 (0,3 ml), приложена най-малко 28 дни след втората доза от тази ваксина, е разрешена за приложение на лица на възраст най-малко 12 години, които са претърпели трансплантация на твърди органи или диагностицирани със състояния, за които се счита, че имат еквивалентно ниво на имунокомпромис.
Подготовка на дозата
Преди разреждане
- Флаконът за многократна ваксина с ваксина Pfizer-BioNTech COVID-19 съдържа обем от 0,45 ml, доставен като замразена суспензия, която не съдържа консервант. Всеки флакон трябва да се размрази и разреди преди приложение.
- Флаконите могат да се размразят в хладилник [2єC до 8єC (35єF до 46єF)] или при стайна температура [до 25єC (77єF)] (вижте Съхранение и боравене ) .
- Вижте инструкциите за размразяване в панелите по -долу.
Разреждане
Разредете съдържанието на флакона с 1,8 ml 0,9% инжектиране на натриев хлорид, USP (не е предоставено), за да образувате ваксината Pfizer-BioNTech COVID-19. САМО използвайте 0,9% инжектиране на натриев хлорид, USP като разредител. Този разредител не е опакован с ваксината и трябва да се набави отделно. Не използвайте бактериостатично 0,9% инжектиране на натриев хлорид или друг разредител . Не добавяйте повече от 1,8 ml разредител.
След разреждане, един флакон съдържа 6 дози от 0,3 ml. Етикетите и картонените опаковки на флакона могат да посочат, че след разреждане флаконът съдържа 5 дози от 0,3 ml. Информацията в този информационен лист относно броя на дозите на флакон след разреждане замества броя на дозите, посочени върху етикетите и картонените опаковки на флакона.
- Вижте инструкциите за разреждане и дозиране в панелите по -долу.
| ПРИГОТВЯНЕ НА ИНДИВИДУАЛНИ ДОЗИ 0,3 мл ВАКСИНА PFIZER-BIONTECH COVID-19 | |
|
Администрация
Визуално проверете всяка доза в дозиращата спринцовка преди приложение. Ваксината ще бъде почти бяла суспензия. По време на визуалната проверка,
- проверете крайния обем на дозиране от 0,3 ml.
- потвърдете, че няма частици и че не се наблюдава обезцветяване.
- не прилагайте, ако ваксината е обезцветена или съдържа прахови частици.
Прилагайте ваксината Pfizer-BioNTech COVID-19 интрамускулно.
След разреждане, флаконите с ваксина Pfizer-BioNTech COVID-19 съдържат шест дози от 0,3 ml ваксина. Спринцовки с малък мъртъв обем и/или игли могат да се използват за извличане на шест дози от един флакон. Ако се използват стандартни спринцовки и игли, може да няма достатъчен обем за извличане на шеста доза от един флакон. Независимо от вида на спринцовката и иглата:
- Всяка доза трябва да съдържа 0,3 ml ваксина.
- Ако количеството ваксина, останало във флакона, не може да осигури пълна доза от 0,3 ml, изхвърлете флакона и съдържанието му.
- Не обединявайте излишната ваксина от няколко флакона.
Противопоказания
Не прилагайте ваксина Pfizer-BioNTech COVID-19 на лица с известна анамнеза за тежка алергична реакция (например анафилаксия) към който и да е компонент на ваксината Pfizer-BioNTech COVID-19 (вижте Пълната информация за предписване на EUA) .
Предупреждения
Управление на остри алергични реакции
Подходящо медицинско лечение, използвано за управление на незабавни алергични реакции, трябва да бъде незабавно на разположение в случай на остра анафилактична реакция след прилагане на ваксина Pfizer-BioNTech COVID-19.
Наблюдавайте реципиентите на Pfizer-BioNTech срещу COVID-19 за появата на незабавни нежелани реакции съгласно указанията на Центровете за контрол и превенция на заболяванията (CDC) (https://www.cdc.gov/vaccines/covid-19/clinical-considerations/ management-anaphylaxis.html).
Миокардит и перикардит
Постмаркетинговите данни показват повишен риск от миокардит и перикардит, особено в рамките на 7 дни след втората доза. Наблюдаваният риск е по -висок сред мъжете под 40 -годишна възраст, отколкото сред жените и по -възрастните мъже. Наблюдаваният риск е най -висок при мъже на възраст от 12 до 17 години. Въпреки че някои случаи изискват подкрепа в интензивно лечение, наличните данни от краткосрочно проследяване показват, че повечето хора са имали разрешаване на симптомите с консервативно лечение. Все още няма информация за потенциални дългосрочни последици. CDC публикува съображения, свързани с миокардит и перикардит след ваксинация, включително за ваксинация на лица с анамнеза за миокардит или перикардит (https://www.cdc.gov/vaccines/covid-19/clinical-considerations/myocarditis.html) .
Синкоп
Синкоп (припадък) може да възникне във връзка с прилагането на инжекционни ваксини, особено при юноши. Трябва да има процедури, за да се избегне нараняване от припадък.
Променена имунокомпетентност
Имунокомпрометирани лица, включително лица, получаващи имуносупресивна терапия, може да имат намален имунен отговор към ваксината Pfizer-BioNTech COVID-19.
Ограничение на ефективността
Ваксината Pfizer-BioNTech COVID-19 може да не защити всички реципиенти.
Нежелани реакции
Нежелани реакции при клинични изпитвания
Нежеланите реакции след ваксината Pfizer-BioNTech COVID-19, които са докладвани в клинични изпитвания, включват болка на мястото на инжектиране, умора, главоболие, мускулни болки, втрисане, болки в ставите, треска, подуване на мястото на инжектиране, зачервяване на мястото на инжектиране, гадене, неразположение и лимфаденопатия (вижте Пълната информация за предписване на EUA) .
Нежелани реакции при опит за разрешаване след публикуване
Тежки алергични реакции, включително анафилаксия и други реакции на свръхчувствителност (напр. Обрив, сърбеж, уртикария, ангиоедем), диария, повръщане и болка в крайниците (ръката) са съобщени след прилагане на ваксината Pfizer-BioNTech COVID-19 извън клинични изпитвания.
Съобщава се за миокардит и перикардит след прилагане на ваксината Pfizer-BioNTech COVID-19 извън клиничните изпитвания.
Допълнителни нежелани реакции, някои от които може да са сериозни, могат да станат очевидни с по-широкото използване на ваксината Pfizer-BioNTech COVID-19.
Използвайте с други ваксини
Няма информация за едновременното приложение на ваксината Pfizer-BioNTech COVID-19 с други ваксини.
ИНФОРМАЦИЯ ЗА ПРЕДОСТАВЯНЕ НА ПОТРЕБИТЕЛИ НА ВАКСИНИ/КАРЕГИВЕРИ
Като доставчик на ваксинации трябва да съобщите на получателя или на неговия болногледач информация, съответстваща на „Информационния бюлетин за ваксините за реципиенти и болногледачи“ (и да предоставите копие или да насочите лицето към уебсайта www.cvdvaccine.com, за да получите ваксината Информационен бюлетин) преди индивидът да получи всяка доза Pfizer-BioNTech ваксина срещу COVID-19, включително:
- FDA разреши спешната употреба на ваксината Pfizer-BioNTech COVID-19, която не е одобрена от FDA ваксина.
- Получателят или неговият болногледач има възможност да приеме или откаже ваксината Pfizer-BioNTech COVID-19.
- Значимите известни и потенциални рискове и ползи от ваксината Pfizer-BioNTech COVID-19 и степента, до която тези рискове и ползи са неизвестни.
- Информация за наличните алтернативни ваксини и рисковете и ползите от тези алтернативи.
За информация относно клиничните изпитвания, които тестват използването на ваксината Pfizer-BioNTech COVID-19 за предотвратяване на COVID-19, моля, вижте www.clinicaltrials.gov .
Предоставете ваксинационна карта на реципиента или на неговия болногледач с датата, на която реципиентът трябва да се върне за втората доза ваксина Pfizer-BioNTech COVID-19.
Предоставете информационния лист v-safe на ваксинаторите/болногледачите и насърчете получателите на ваксини да участват във v-safe. V-safe е нов доброволен инструмент, базиран на смартфон, който използва текстови съобщения и уеб проучвания, за да се свърже с хора, които са били ваксинирани, за да идентифицират потенциалните странични ефекти след ваксинацията срещу COVID-19. V-safe задава въпроси, които помагат на CDC да следи безопасността на ваксините срещу COVID-19. V-safe също така предоставя напомняния за втора доза, ако е необходимо, и проследяване по телефона на живо от CDC, ако участниците съобщават за значително въздействие върху здравето след ваксинацията срещу COVID-19. За повече информация посетете: www.cdc.gov/vsafe.
ЗАДЪЛЖИТЕЛНИ ИЗИСКВАНИЯ ЗА АДМИНИСТРИРАНЕ НА ВАКСИНА PFIZER-BIONTECH ПРОТИВ АВТОРИЗАЦИЯ 3
За да се смекчат рисковете от използването на този неодобрен продукт съгласно EUA и да се оптимизира потенциалната полза от ваксината Pfizer-BioNTech COVID-19, са необходими следните елементи. Използването на неодобрена ваксина Pfizer-BioNTech за COVID-19 за активна имунизация за предотвратяване на COVID-19 съгласно настоящото EUA е ограничено до следното (всички изисквания трябва да бъдат изпълнени):
- Ваксината Pfizer-BioNTech COVID-19 е разрешена за употреба при лица на 12 и повече години.
- Доставчикът на ваксинация трябва да съобщи на лицето, което получава ваксината Pfizer-BioNTech COVID-19, или на техния болногледач, информация, съответстваща на „Информационния бюлетин за ваксините за реципиенти и болногледачи“, преди лицето, което получава ваксината Pfizer-BioNTech COVID-19.
- Доставчикът на ваксина трябва да включва информация за ваксинацията в Имунизационната информационна система (IIS) на държавната/местната юрисдикция или друга определена система.
- Доставчикът на ваксинация е отговорен за задължителното докладване на следното в Системата за докладване на нежелани събития при ваксина (VAERS):
- грешки при прилагане на ваксина, независимо дали са свързани или не с нежелано събитие,
- сериозни нежелани събития* (независимо от приписването на ваксинация),
- случаи на мултисистемния възпалителен синдром (MIS) при възрастни и деца, и
- случаи на COVID-19, които водят до хоспитализация или смърт.
- Доставчикът на ваксинация е отговорен за отговорите на исканията на FDA за информация за грешки при прилагане на ваксината, нежелани събития, случаи на MIS при възрастни и деца и случаи на COVID-19, които водят до хоспитализация или смърт след прилагане на ваксина Pfizer-BioNTech COVID-19 към получателите.
* Сериозните нежелани събития се дефинират като:
- Смърт;
- Животозастрашаващо нежелано събитие;
- Хоспитализация в болница или удължаване на съществуващата хоспитализация;
- Продължителна или значителна неработоспособност или значително нарушаване на способността за извършване на нормални житейски функции;
- Вродена аномалия/вроден дефект;
- Важно медицинско събитие, което въз основа на подходяща медицинска преценка може да застраши индивида и може да изисква медицинска или хирургическа намеса, за да се предотврати един от изброените по -горе резултати.
ДРУГИ НЕЖЕЛАНИ СЪБИТИЯ, ДОКЛАДВАНЕ НА VAERS AND PFIZER INC.
Доставчиците на ваксинации могат да докладват на VAERS за други нежелани събития, които не се изискват да бъдат докладвани, като се използва информацията за контакт по -горе.
Доколкото е възможно, докладвайте за нежелани събития на Pfizer Inc., като използвате информацията за контакт по -долу или като предоставите копие на формуляра VAERS на Pfizer Inc.
| Уебсайт | Номер на факс | Телефонен номер |
|---|---|---|
| www.pfizersafetyreporting.com | 1-866-635-8337 | 1-800-438-1985 |
ДОПЪЛНИТЕЛНА ИНФОРМАЦИЯ
За общи въпроси посетете уебсайта или се обадете на посочения по -долу телефонен номер.
За достъп до най-новите информационни бюлетини за ваксините на Pfizer-BioNTech COVID-19, моля, сканирайте предоставения по-долу QR код.
| Глобален уебсайт | Телефонен номер |
|---|---|
| 1-877-829-2619 (1-877-VAX-CO19) |
НАЛИЧНИ АЛТЕРНАТИВИ
COMIRNATY (ваксина срещу COVID-19, мРНК) е одобрена от FDA ваксина срещу COVID-19, произведена от Pfizer за BioNTech. Той е одобрен като серия от 2 дози за употреба при лица на възраст 16 и повече години. COMIRNATY (ваксина срещу COVID-19, иРНК) също е разрешена за спешна употреба при лица на възраст от 12 до 15 години и за предоставяне на трета доза на лица на възраст 12 и повече години, за които е установено, че имат определени видове имунокомпромис. COMIRNATY (ваксина срещу COVID-19, иРНК) има същата формулировка като ваксината срещу COVID-19 Pfizer-BioNTech. Тези ваксини могат да се използват взаимозаменяемо, за да се осигури серия от ваксинации срещу COVID-19. 4
Възможно е да има клинични изпитвания или наличност под EUA на други ваксини срещу COVID-19.
ФЕДЕРАЛНА ПРОГРАМА ЗА ВАКЦИНАЦИЯ срещу COVID-19
Тази ваксина се предоставя за спешна употреба изключително чрез Програмата за ваксиниране на CDC COVID-19 (Програмата за ваксинация). Доставчиците на здравни услуги трябва да се запишат като доставчици в програмата за ваксинация и да спазват изискванията на доставчика. Доставчиците на ваксинации не могат да начисляват никаква такса за ваксината и не могат да таксуват получателя на ваксината за такса за администриране. Доставчиците на ваксинации обаче могат да търсят подходящо възстановяване на средства от програма или план, които покриват таксите за администриране на ваксината срещу COVID-19 за получателя на ваксината (частна застраховка, Medicare, Medicaid, Администрация на здравните ресурси и услуги [HRSA] Незастрахована програма за COVID-19 за незастраховани лица получатели). За информация относно изискванията на доставчика и записването в програмата за ваксиниране на CDC срещу COVID-19 вижте https: //www.cdc.
Хората, които разберат за евентуални нарушения на изискванията на програмата за ваксиниране на CDC COVID-19, се насърчават да ги докладват в Службата на Генералния инспектор, Министерството на здравеопазването и човешките услуги на САЩ, на 1-800-HHS-TIPS или https: // СЪВЕТИ.HHS.GOV.
ОРГАН ЗА ИЗДАВАНЕ НА ЕС
Секретарят по здравеопазването и човешките услуги (HHS) обяви извънредно положение за общественото здраве, което оправдава спешната употреба на лекарства и биологични продукти по време на пандемията COVID-19. В отговор FDA издаде EUA за неодобрения продукт, Pfizer-BioNTech ваксина срещу COVID-19, за активна имунизация срещу COVID-19 при лица на 12 и повече години и за предоставяне на трета доза на лица на 12 и повече години за които е установено, че имат определени видове имунокомпромис. Одобрената от FDA COMIRNATY също е разрешена за лица на възраст от 12 до 15 години и да предоставя трета доза на лица на възраст 12 и повече години, за които е установено, че имат определени видове имунокомпромис.
FDA издаде този EUA въз основа на искането на Pfizer-BioNTech и предоставените данни.
За разрешените употреби, въпреки че има ограничена научна информация, въз основа на общия брой научни доказателства, налични до момента, е разумно да се смята, че ваксината Pfizer-BioNTech срещу COVID-19 и COMIRNATY могат да бъдат ефективни за превенцията на COVID-19 при лица, както е посочено в Пълната информация за предписване на EUA .
Това EUA за Pfizer-BioNTech ваксина срещу COVID-19 и COMIRNATY ще приключи, когато секретарят на HHS установи, че обстоятелствата, оправдаващи EUA, вече не съществуват или когато има промяна в статуса на одобрение на продукта, така че EUA вече не е необходими.
За допълнителна информация относно разрешение за използване при спешни случаи посетете FDA на: https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization .
Програмата за компенсиране на наранявания при нараняване
Програмата за компенсиране на наранявания при контрмери (CICP) е федерална програма, която е създадена, за да подпомогне плащането на свързаните с нея разходи за медицинско обслужване и други специфични разходи за обезщетение на хора, ранени след използване на определени медицински мерки. Медицинските мерки за противодействие са специфични ваксини, лекарства, устройства или други предмети, използвани за предотвратяване, диагностициране или лечение на обществеността по време на извънредна ситуация за общественото здраве или заплаха за сигурността. За повече информация относно CICP относно ваксината Pfizer-BioNTech COVID-19, използвана за предотвратяване на COVID-19, посетете www.hrsa.gov/cicp , имейл cicp@hrsa.gov или се обадете на: 1-855-266-2427.
Тагове:

