2. radostinalassa
3. leonleonovpom2
4. varg1
5. kvg55
6. wonder
7. planinitenabulgaria
8. mt46
9. sparotok
10. hadjito
11. getmans1
12. stela50
13. zaw12929
14. tota
2. katan
3. wonder
4. leonleonovpom2
5. mt46
6. vidima
7. dobrota
8. bojil
9. ambroziia
10. donkatoneva
2. vesonai
3. radostinalassa
4. lamb
5. samvoin
6. hadjito
7. manoelia
8. bateico
9. mimogarcia
10. sekirata

Прочетен: 255 Коментари: 0 Гласове:
Последна промяна: 05.03.2020 11:35
https://www.nature.com/articles/d41586-
Някои бактерии използват мултипротеинови комплекси за инжектиране на протеини в гостоприемни клетки. Компонентите на тези комплекси са свързани по начин, медииран от нанотръби, от клетки-гостоприемници до бактерии, които могат да осигурят храна за болестотворни микроби. Хорхе Е. Галан
Сред най-вълнуващите разработки през последните две десетилетия на проучванията на механизмите, чрез които бактериите причиняват заболяване, беше откритието, че много такива микроорганизми имат способността да пренасят бактериално кодирани протеини директно в клетките, които заразяват 1 . Прехвърлените протеини са известни като ефектори и те изпълняват различни роли в модулирането на клетъчните процеси за насърчаване на бактериална инфекция. Този забележителен подвиг на трансфер се постига от протеинови комплекси, които образуват инжекционни машини. Една от най-разпространените машини за инжектиране е секреционната система тип III (T3SS), която функционира при много болестотворни бактерии 2 . Писане в Cell , Pal et al . 3докладвайте за интригуващата констатация, че подмножество от компонентите, които съставляват T3SS в причиняващ заболяване щам на бактерията Escherichia coli, са преместени, за да подпомогнат създаването на структура с нанотръби върху повърхността на бактериалната клетка, която може да участва в транспортиране на молекули в обратна посока: от клетката гостоприемник до бактерията.
Произходът на това откритие може да се проследи от предишни изследвания 4 , 5 , които документираха наличието на нанотръбни структури на повърхността на някои видове бактерии. Въпреки че съставът на структурите на нанотръбите не е напълно разбран, известно е, че те могат да образуват мостове между съседните бактериални клетки 6 или връзки между бактерии и клетки бозайници-бозайници по време на инфекция (фиг. 1) 4 . Функцията на тези структури остава неуловима, въпреки че се предполага, че те участват в транспортиране на молекули между бактерии 6 или улесняване на разпространението на сигнали от бактерии към клетки на бозайници 4 .
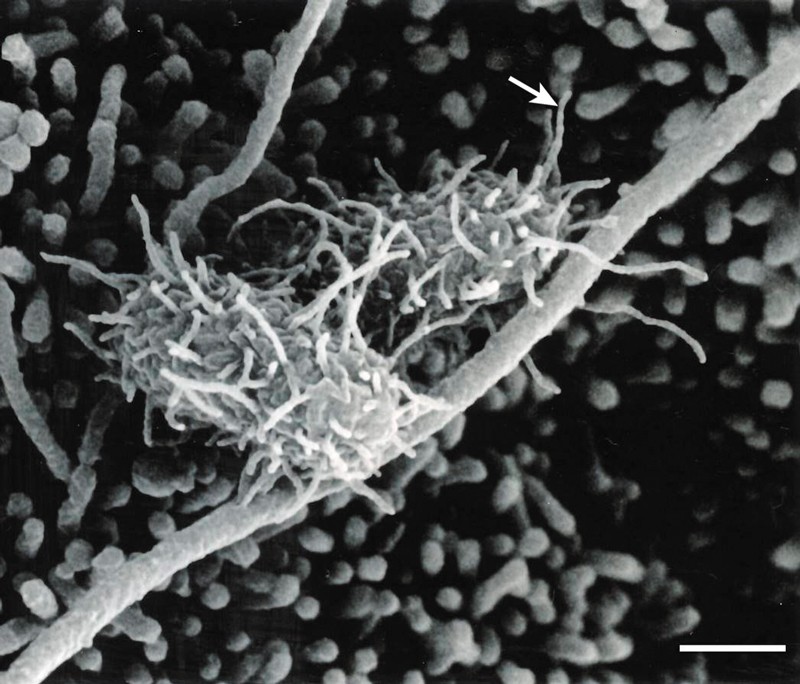
Фигура 1 | Бактериални нанотръби. Бактериалните нанотръби (стрелка) могат да образуват връзки между клетки-гостоприемници на бозайници и бактериални клетки (показани тук са нанотръбички на повърхността на Salmonella Typhimurium бактерии, които са в контакт с кучешки бъбречни клетки, отглеждани in vitro ) 4 . Pal и др. 3 предоставят доказателства, които предполагат, че такива връзки могат да бъдат използвани от бактерии за получаване на хранителни вещества от клетки на бозайници. Скала, 0,5 микрометра. Кредит: CC Ginocchio et al./Cell
Pal и др . представят данни, които предполагат структурите на нанотръбите в потенциалното директно пречистване на хранителни вещества от клетки-гостоприемници. Авторите са проектирали E. coli да експресира флуоресцентен протеин само когато бактериалните клетки съдържат нормални нива на аминокиселината пролин. Ако авторите растат клетките в условия на глад от аминокиселини, флуоресцентният протеин не се експресира. Но ако бактериите при такива условия също са били в контакт с клетки на бозайници, те изразяват флуоресцентния протеин. Това показва, че микробите са реагирали така, сякаш получават хранителни вещества.
Тези експерименти обаче не биха могли да разделят дали нанотръбите се използват директно за подхранване на хранителни вещества и, ако са, дали пренасят хранителни вещества от повърхността на клетката гостоприемник или от цитоплазмата на вътрешността на клетката гостоприемник. Последният сценарий вероятно ще изисква нанотръбите да имат способността да пробиват клетъчната мембрана на клетката гостоприемник. Авторите също така съобщават, че мембранно пропускливото багрило може да бъде прехвърлено от бозайникова клетка-домакин, отглеждана in vitro, в бактерия само когато и двата типа клетки са в близък контакт.
Няма обаче пряко доказателство, че нанотръбите всъщност посредничат в молекулярния транспорт - данните на авторите осигуряват само корелация между наличието на тези структури и хранителната реакция на бактериите или придобиването на багрилото. Следователно не са изключени алтернативни обяснения на наблюденията, включително участието на нанотръбите в улесняване на интимните взаимодействия между бактериите и клетките гостоприемници, които водят до придобиване на хранителни вещества чрез друг механизъм. Нещо повече, идентичността на молекулата или молекулите, които обикновено пътуват по предложен от авторите маршрут, остава неизвестна. Въпреки това, въпреки че остават въпроси, данните са достатъчно убедителни, за да подкрепят модела на Pal и колегите.
Експерименти от Pal et al . показват, че образуването на нанотръби зависи от експресията само на подмножество от компонентите, които образуват T3SS в Е. coli, Известен също като инжекцион, T3SS се състои от две основни мултипротеинови подструктури: протеинов комплекс, наречен платформа за цитоплазмена сортиране, която е отговорна за избора на ефектори, които да бъдат доставени от T3SS; и игленият комплекс, който медиира преминаването на ефектори през бактериалната клетъчна мембрана. Дълбоко в игления комплекс се намира експортният апарат - група от няколко мембранни протеина, които подпомагат преминаването на ефектори през вътрешната мембрана на бактериалната клетка (някои бактериални клетки са заобиколени както от вътрешна, така и от външна мембрана). Тези протеинови апарати за експорт съставляват подмножеството от компоненти на T3SS, необходими за задвижване на образуването на нанотръби в експерименталната система на авторите.
Пал и колеги откриха, че само експресията на експортния апарат е достатъчна, за да се образуват нанотръби в Е. coli . Това наблюдение намеква за механизмите, които могат да доведат до сглобяване на нанотръби: като се има предвид, че протеините на апарата за износ се намират във вътрешната мембрана на бактерията, могат ли по някакъв начин да стимулират мембраната да образува тръби, което води до образуване на нанотръби? Протеините на експортния апарат са еволюционно силно запазени и авторите съобщават, че нанотръбите могат да се образуват в Е. coli, които са проектирани да експресират апаратите за износ на други бактериални видове T3SS. Нанотръбите също са направени, когато авторите са проектирали E. coliда експресират компоненти на бактериална структура, наречена флагел, която има роля в микробната подвижност и съдържа протеини, които са свързани с тези, които образуват T3SS.
Като се има предвид местоположението на експортния апарат в основата на T3SS, използването на протеини за износ на апарати за задвижване на образуването на нанотръби би било несъвместимо с тези компоненти, които също функционират като част от инжектирането. Това предполага, че ще е необходим регулаторен механизъм, който да гарантира, че протеините на апаратите за износ се назначават, за да образуват или инжекцион, или нанотръба. Интригуващо е, че в T3SSs на повечето видове бактерии, гените, които кодират експортния апарат, са групирани заедно в различен генетичен регион от този, съдържащ гените, кодиращи други компоненти на игления комплекс. Тази организация може да подпомогне различно регулираното производство на игловия комплекс и апарата за износ.
Pal и сътр . представят някои косвени доказателства, че отделни бактериални клетки могат да бъдат едновременно ангажирани с набиране на хранителни вещества, като се използват нанотръби и инжектор чрез ефектор чрез инжектиома. Това би предложило по-сложен регулаторен механизъм за системата, отколкото просто диференциално генно изразяване на компонентите. Нанотрубки са открити на повърхностите на бактериални клетки, които изглежда не участват в T3SS-медиираното инжектиране на ефектори 4 . Следователно е възможно, преди да се свържат с клетки-гостоприемници, определени популации от бактериални клетки са готови или за събиране на инжектизоми, или за образуване на нанотръби.
Проучването на Пал и колегите му повдига много въпроси, които са достойни за по-нататъшни изследвания. Как се сглобяват нанотръбите? Транспортът се извършва само в една посока - например от клетката гостоприемник до бактерията - или може да бъде двупосочен? Селективен ли е транспортът за определени видове съединения? Следете отговорите, защото, несъмнено, предстоят още изненади.

